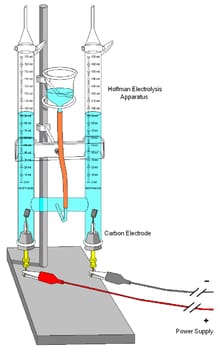
 Hình minh họa một máy điện phân được dùng trong phòng thí nghiệm ở trường học .
Hình minh họa một máy điện phân được dùng trong phòng thí nghiệm ở trường học .
Trong hóa học và sản xuất chế tạo, điện phân là một phương thức dùng một dòng điện một chiều để thúc đẩy một phản ứng hóa học mà nếu không có dòng điện nó không tự xảy ra. Điện phân có tầm quan trọng cao về mặt thương mại do nó là một khâu trong việc tách riêng các nguyên tố hóa học từ những nguồn tài nguyên trong tự nhiên như quặng. Điện áp cần thiết để hiện tượng điện phân xảy ra được gọi là thế điện phân. Quá trình điện phân về bản chất là quá trình ngược với pin điện hóa.
Phân loại Điện phân
Có hai loại điện phân : Điện phân nóng chảy và Điện phân dung dịch .
Bạn đang đọc: Điện phân là gì!Điện phân nóng chảy
Điện phân dung dịch
Điện cực dương (cực dương, dương cực, catot) là điện cực nối với cực dương của nguồn điện một chiều, là nơi hút các điện tử (anio)) về và xảy ra quá trình oxy hóa.
Điện phân là gì!
Điện cực âm ( âm cực, cực âm, anot ) là điện cực nối với cực âm của nguồn điện một chiều, là nơi những cation chạy về và xảy ra quy trình khử. Thực nghiệm cho thấy khi điện phân dung dịch chứa những ion sắt kẽm kim loại đứng sau nhôm ( Al ) trong dãy thế điện hóa thì những ion sắt kẽm kim loại này bị khử tạo thành sắt kẽm kim loại bám vào điện cực catot. Ion nào càng đứng sau thì có tính oxy hóa càng mạnh nên càng bị khử trước ở catot .
Thế điện cực
● Suất điện động :Hiệu của thế điện cực dương ( E ( + ) ) với thế điện cực âm ( E ( – ) ) được gọi là suất điện động của pin điện hóa :Epin = E ( + ) – E ( – )( ở ví dụ này E0pin = E0 ( Cu2 + / Cu ) – E0 ( Zn2 + / Zn ) ) .
● Thế điện cực chuẩn sắt kẽm kim loại :
– Điện cực KL mà nồng độ ion KL trong dung dịch bằng 1M được gọi là điện cực chuẩn .- Thế điện cực chuẩn của KL cần đo được gật đầu bằng sđd của pin tạo bởi điện cực hydro chuẩn và điện cực chuẩn của KL cần đo .- Nếu KL đóng vai cực âm, thì thế điện cực chuẩn của KL có giá trị âm, nếu đóng vai trò cực dương thì thế điện cực chuẩn của KL có gía trị dương .
Ý nghĩa của dãy thế điện cực chuẩn của KL .
● So sánh tính oxy hóa-khử :
Trong dung dịch nước thế điện cực chuẩn của KL E0Mn + / M càng lớn thì tính oxy hóa của cation Mn + và tính khử của KL M càng yếu. ( ngược lại ) .
● Xác định chiều của phản ứng oxi-hóa khử :
Cation KL trong cặp oxihóa-khử có thế điện cực chuẩn lớn hơn hoàn toàn có thể oxihóa được KL trong cặp có thế điện cực chuẩn nhỏ hơn .- dựa vào thế điện cực chuẩn của KL để sắp xếp nhỏ bên trái, lớn bên phải .- viết phương trình phản ứng theo quy tắc anpha ( ) .KL trong cặp oxihóa-khử có thế ĐCC âm khử được ion H + của dung dịch axit .
● Xác định suất điện động chuẩn của pin điện hóa :
Epin = E ( + ) – E ( – )suất điện động của pin điện hóa luôn là số dương
● Xác định thế điện cực chuẩn của cặp oxy hóa-khử :
E0pin X-Y = E0Yn + / Y – E0Xm + / XKhi biết E0pin X-Y, nếu biết E0Yn + / Y Þ E0Xm + / XVí dụ :Xác định E0Ni2 + / Ni. Biết E0pin Ni-Cu = 0,60 V, E0Cu2 + / Cu = 0,34 VE0pin Ni-Cu = E0Cu2 + / Cu – E0Ni2 + / NiÞ E0Ni2 + / Ni = 0,34 – 0,6 = – 0,28 V
• Bảng giá trị thế điện cực chuẩn
Phản ứng xảy ra
Điện phân nóng chảy
Điện phân chất điện li nóng chảy
Ví dụ 1: Điện phân NaCl nóng chảy có thể biểu diễn bằng sơ đồ:
Catot ( – ) ← NaCl → Anot ( + )Na + + 1 e → Na 2C l – → Cl2 + 2 ePhương trình điện phân : 2N aCl → 2N a + Cl2
Ví dụ 2: Điện phân Al2O3 nóng chảy pha thêm criolit (Na3AlF6) có thể biểu diễn bằng sơ đồ:
Catot ( – ) ← Al2O3 → Anot ( + )4 | Al3 + + 3 e → Al 3 | 2O2 – → O2 + 4 ePhương trình điện phân là : 2A l2O3 → 4A l + 3O2
Điện phân dung dịch
– Tại catot xảy ra quy trình khử cation ( sau Al ) : Mn + + ne → M- Nếu điện phân dung dịch có những cation K +, Na +, Ca2 +, Ba2 +, Mg2 +, Al3 + thì H2O sẽ tham gia điện phân theo PT : 2H2 O + 2 e → H2 + 2OH — Nếu trong dung dịch có nhiều cation thì cation nào có tính oxy hóa mạnh hơn sẽ bị điện phân trước . Tại anot xảy ra quy trình oxy hóa anion : Xn – → X + ne* Gốc axit không chứa oxi như Cl -, S2 – … hoặc ion OH – của base kiềm hoặc nước thì tham gia điện phân .Thứ tự anion bị oxy hóa : S2 – > I – > Br – > Cl – > RCOO – > OH – > H2OGốc axit có chứa oxi NO3 –, SO42 –, PO43 –, CO32 –, ClO4 – … thì nước tham gia điện phân : 2H2 O → O2 + 4H + + 4 e
Nếu Anode không tan :
Nếu anode là chất trơ ( không tan, như Bạch kim ( Pt ), than chì ( hoàn toàn có thể dùng lõi pin ), những anion không chứa oxi sẽ bị oxy hóa ở anode, khi không còn anion không chứa oxi, nước sẽ bị oxy hóa, khi hết nước, quy trình điện phân sẽ ngừng . Nếu anode không trơ thì anode sẽ bị tan và hoàn toàn có thể phản ứng với dung dịch điện phân .
Nếu không có vách ngăn giữa hai cực:
Xem thêm: Catch tiếng Việt là gì
Thường thì bình điện phân có vách ngăn xốp ngăn thành hai phần, một phần chứa cathode, một phần chứa anode, nhưng nếu bỏ vách ngăn này, những chất tạo thành do điện phân sẽ phản ứng với dung dịch . Điện phân dung dịch NaCl không có vách ngăn, ta được nước Javel do Cl2 sinh ra phản ứng với NaOH tạo thành do điện phân :2N aCl + 2H2 O đp => H2 + NaOH + Cl22N aOH + Cl2 = NaCl + NaClO + H2O ( hỗn hợp này gọi là nước Javel )
Ví Dụ phản ứng điện phân
Ví dụ 1: Điện phân NaCl nóng chảy có thể biểu diễn bằng sơ đồ:
Catot ( – ) ← NaCl → Anot ( + )Na + + 1 e → Na 2C l – → Cl2 + 2 ePhương trình điện phân : 2N aCl → 2N a + Cl2
Ví dụ 2: Điện phân Al2O3 nóng chảy pha thêm criolit (Na3AlF6) có thể biểu diễn bằng sơ đồ:
Catot ( – ) ← Al2O3 → Anot ( + )4 | Al3 + + 3 e → Al 3 | 2O2 – → O2 + 4 ePhương trình điện phân là : 2A l2O3 → 4A l + 3O2
Ví dụ 3: Điện phân dung dịch CuCl2
với anot trơ có thể biểu diễn bằng sơ đồ:
Catot ( – ) ← CuCl2 → Anot ( + )Cu2 + + 2 e → Cu 2C l – → Cl2 + 2 ePhương trình điện phân : CuCl2 → Cu + Cl2
Ví dụ 4: Điện phân dung dịch NaCl bão hòa với điện cực trơ có màng ngăn có thể biểu diễn bằng sơ đồ:
Catot ( – ) ← NaCl → Anot ( + )H2O, Na + ( H2O ) Cl -, H2O2H2 O + 2 e → H2 + 2OH – 2C l – → Cl2 + 2 ePhương trình điện phân : 2N aCl + 2H2 O → 2N aOH + H2 + Cl2Nếu không có màng ngăn thì : Cl2 + 2N aOH → NaCl + NaClO + H2O=> phương trình điện phân : NaCl + H2O → NaClO + H2
Ví dụ 5: Điện phân dung dịch NiSO4 với anot trơ có thể biểu diễn bằng sơ đồ:
Catot ( – ) ← NiSO4 → Anot ( + )Ni2 +, H2O ( H2O ) H2O, SO42 -Ni2 + + 2 e → Ni 2H2 O → O2 + 4H + + 4 ePhương trình điện phân là : 2N iSO4 + 2H2 O → 2N i + 2H2 SO4 + O2
Ví dụ 6: Điện phân dung dịch NiSO4 với anot bằng Cu có thể biểu diễn bằng sơ đồ:
Catot ( – ) ← NiSO4 → Cu ( + )Ni2 +, H2O ( H2O ) H2O, SO42 -Ni2 + + 2 e → Ni Cu → Cu2 + + 2 ePhương trình điện phân là : NiSO4 + Cu → CuSO4 + Ni
Ví dụ 7: Điện phân dung dịch hỗn hợp chứa FeCl3, CuCl2 và HCl với anot trơ có thể biểu diễn bằng sơ đồ:
Catot (–)
← FeCl3, CuCl2, HCl →
Anot (+)
Fe3+, Cu2+, H+ Fe3 + + 1 e → Fe2 +Cu2 + + 2 e → Cu2H + + 2 e → H2Fe2 + + 2 e → Fe
2Cl- → Cl2 + 2e
Định luật Faraday
Định Luật Điện phân Faraday:
Khối lượng chất giải phóng ở mỗi điện cực tỉ lệ với điện lượng đi qua dung dịch và đương lượng của chất:
m =
A . I . t
n . F
{\displaystyle m={\frac {A.I.t}{n.F}}}

Trong đó:
+ m : khối lượng chất giải phóng ở điện cực ( gam )+ A : khối lượng mol nguyên tử của chất thu được ở điện cực+ n : số electron mà nguyên tử hoặc ion đã cho hoặc nhận+ I : cường độ dòng điện ( A )+ t : thời hạn điện phân ( s )+ F : hằng số Faraday ( F = 1,602. 10 − 19.6,022. 1023 ≈ 96500 C.mol − 1 )
Biểu thức liên hệ:
n =
I . t
F
{\displaystyle n={\frac {I.t}{F}}}

Ứng dụng Điện phân
– Điều chế sắt kẽm kim loại- Điều chế 1 số ít phi kim : H2, O2, F2, Cl2
– Điều chế một vài hợp chất: NaOH, nước Giaven
– Tinh chế sắt kẽm kim loại : Cu, Pb, Zn, Fe, Ag, Au- Mạ điện : Cu, Ag, Au, Cr, Ni
^ The Supplement ( 1803 edition ) to Encyclopedia Britannica 3 rd edition ( 1797 ), và volume 1, page 225, ” Mister Van Marum, by means of his great electrical machine, decomposed the calces of tin, zinc, and antimony, and resolved them into their respective metals and oxygen ” and gives as a reference Journal de Physiques, 1785 .
